Instrucciones
Usted tiene las siguientes opciones en este simulador para moléculas pequeñas tanto inorgánicas como orgánicas.
- En la parte superior, aparecen los botones 2D y 3D para que pueda observar el modelo en dos o tres dimensiones.
- A continuación se presenta el modelo en dos o tres dimensiones.
- "Search" puede ser utilizado para buscar alguna molécula, escribiendo el nombre en inglés, por ejemplo al escribir, sulphuric acid (ácido sulfúrico).
- Color de fondo, sirve seleccionar el color del fondo del modelo en tres dimensiones.
- Girar X, Y, Z, para girar el modelo en tres dimensiones en los ejes x, y, z.
- Alambres, varillas y pelotas y varillas, para cambiar el modelo en tres dimensiones en esas representaciones.
- Energía, aparce en la parte superior la energía de la molécula en kJ/mol o kcal/mol.
- Minmizar por MMFF94, normalmente las estructuras iniciales que se crean en los simuladores poseen energías mucho mayores a las que tendría un objeto real, por esta razón, se utilizan algoritmos para calcular las posiciones y fuerzas originales, con el objetivo de minimizarlas y que sean más realistas.
- Arrastrar Minimizar, usted puede arrastrar un átomo, soltarlo y entonces el sistema hace un cálculo de minimización de energía.
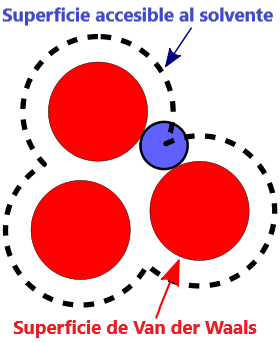
- Superficie VDW, La superficie de van der Waals de una molécula es una representación abstracta o modelo de esa molécula, que ilustra dónde, en términos muy generales, podría haber una superficie para la molécula en función de los cortes duros de los radios de van der Waals para átomos individuales, y representa una superficie a través de la cual la molécula podría concebirse interactuando con otras moléculas.
- PEM es el mapa de potencial electrostático.
- Cargas parciales, para ver el valor de la carga relativa positiva o negativa de cada átomo.
- Tetraedros, para el caso que exista alguna átomo tetraédrico.
- Dipolos enlaces, para ver el los dipolos de todos los enlaces.
- Dipolo molecular, para ver el momento dipolar resultante de toda la molécula.
- Botón 2D, cuando escoge el botón 2D, la aplicación tiene su propio menú y quedan inhabilitados todos los botones 3D.
Laboratorio de IA: Analista Químico
Consultando al Experto Virtual
Las PPM son la base de la química ambiental y analítica. Usa la IA para entender la ciencia detrás de los titulares. Copia estos prompts para elevar tu nivel de análisis:
1. El Mito del "Cero"
Límite de Detección (LOD) vs Realidad.
2. El Asesino Invisible
Biomagnificación y Solubilidad.
3. La Trampa de la Densidad
mg/L no siempre es ppm.
Soluciones

Podcast: Entendiendo lo Invisible
Escucha cómo una pequeña cantidad puede hacer una gran diferencia.
Video: La Ciencia de lo Pequeño
Presentación Resumida
Para mejor experiencia en celular, abre la guía directamente:
Abrir Guía PDFLa presentación contiene gráficas de alta calidad.
Infografía Resumen

Guía visual rápida sobre conceptos clave de PPM.
El Poder de lo Pequeño
Imagina que eres el responsable de la seguridad del agua en tu ciudad.
Te enfrentas a un dilema invisible: un exceso de flúor puede dañar los huesos de la población, pero una cantidad muy baja no protegerá sus dientes contra las caries. O peor aún, ¿cómo detectas si hay plomo (tóxico) en el agua cuando está presente en cantidades que el ojo humano jamás vería?
Para manejar estas sustancias críticas—ya sea el veneno o la medicina—los científicos necesitan una herramienta de precisión extrema. Esa herramienta son las Partes por Millón (ppm).
¿Qué tan pequeño es 1 ppm?
Antes de calcular, visualicemos la magnitud. 1 ppm significa "una unidad en un millón de unidades". Es difícil de imaginar, así que usemos analogías del mundo real:
Analogía Temporal
Un año tiene aproximadamente 31.5 millones de segundos.
1 ppm de un año equivaldría a tan solo 32 segundos.
Analogía Visual
Imagina un contenedor con un millón de granos de arroz blanco.
1 ppm sería encontrar un solo grano de arroz pintado de rojo en toda esa montaña.
La Lógica de los Ceros: ¿Por qué mg/L?
Muchas veces verás la fórmula simplificada: ppm = mg/L. ¿De dónde viene esto? No es una aproximación mágica, es simplemente contar ceros.
Sigue esta deducción matemática de 3 pasos:
- Imagina 1 Litro de agua (o una solución muy diluida).
- Ese litro pesa exactamente 1 kilogramo (1,000 gramos).
- Si convertimos ese kilogramo a miligramos, multiplicamos por mil otra vez:
1,000 g × 1,000 = 1,000,000 mg (Un Millón de miligramos).
¡Eureka!
Si disuelves 1 mg de soluto en ese Litro, tienes literalmente:
1 parte (mg) en 1,000,000 de partes (mg).
Eso es exactamente 1 ppm.
Desafíos de Laboratorio
Contexto: Recibes una muestra de 825 mL de agua de un pozo municipal. Tu análisis detecta 3.5 mg de iones fluoruro.
Tu Misión: Calcular la concentración en ppm para reportarla a la agencia de salud.
(Intenta resolverlo mentalmente antes de ver la solución)
Paso 1: Identifica tus datos. Masa = 3.5 mg. Volumen = 0.825 L (recuerda pasar mL a L).
Paso 2: Aplica la lógica. ppm = mg / L.

Interpretación: El agua tiene 4.24 partes de flúor por cada millón de partes de agua.
Contexto: Sabes que un lago tiene una concentración de flúor de 4.0 ppm. Un investigador tomó una muestra de 1.25 Litros.
Tu Misión: Determinar exactamente cuánta masa de flúor (soluto) hay en esa botella.
Paso 1: Despejar la fórmula. Si ppm = mg / L, entonces mg = ppm × L.

Resultado: Hay 5.0 mg de fluoruro en la muestra.
Contexto: Tienes un residuo industrial concentrado que contiene 150 mg de iones de cobre (Cu+2). La normativa ambiental prohíbe desechar cualquier líquido con más de 5.0 ppm de cobre.
Tu Misión: Calcular el volumen mínimo de agua en el que debes disolver este residuo para que sea legal desecharlo.
Paso 1: Despejar la fórmula para Volumen (L).
Si ppm = mg / L, entonces el Volumen (L) pasa a multiplicar y
ppm pasa a dividir:
L = mg / ppm.
Resultado: Necesitas diluir los 150 mg en al menos 30 Litros de agua para cumplir la ley.
Esta serie de 9 ejercicios te guiará para dominar el cálculo de partes por millón.
I. Calculando ppm (ppm = mg / L)
1. Detergente en Río
Una muestra de 5.0 L de agua de río contiene 12 mg de detergente. Calcule la concentración en ppm.
Cálculo:
| 12 mg Detergente | = | 2.4 ppm |
| 5.0 L Agua |
2. Calcio en Leche
Un vaso con 0.200 L de leche contiene 250 mg de Calcio. ¿Cuál es su concentración en ppm?
Cálculo:
| 250 mg Ca | = | 1250 ppm |
| 0.200 L Leche |
3. Cloro en Piscina
Al analizar 2.5 L de agua de una piscina, se encontraron 7.5 mg de Cloro. Calcule las ppm.
Cálculo:
| 7.5 mg Cl | = | 3.0 ppm |
| 2.5 L Agua |
II. Calculando Masa (mg = ppm x L)
4. Sodio en Bebida
Una energizante tiene 150 ppm de sodio. ¿Cuántos mg de sodio ingieres si bebes 0.600 L?
Cálculo:
| 0.600 L Bebida | x | 150 mg Na | = | 90 mg Na |
| 1 L Bebida |
5. Nitratos en Acuario
Un acuario de 80 L tiene una concentración de nitratos de 20 ppm. ¿Cuál es la masa total de nitratos disueltos?
Cálculo:
| 80 L Agua | x | 20 mg Nitratos | = | 1600 mg (1.6 g) |
| 1 L Agua |
6. Pesticida en Muestra
Se extrajeron 2.0 L de agua subterránea contaminada con 0.5 ppm de pesticida. ¿Cuántos mg de pesticida contiene?
Cálculo:
| 2.0 L Agua | x | 0.5 mg Pesticida | = | 1.0 mg Pesticida |
| 1 L Agua |
III. Calculando Volumen (L = mg / ppm)
7. Tanque de Tratamiento
Debes clorar un tanque usando 500 mg de Cloro para alcanzar exactamente 2.0 ppm. ¿Qué volumen de agua puedes tratar?
Cálculo:
| 500 mg Cl | x | 1 L Agua | = | 250 L Agua |
| 2.0 mg Cl |
8. Estándar de Laboratorio
Tienes 25 mg de soluto patrón y necesitas preparar una solución de 100 ppm. ¿En qué volumen debes disolverlo?
Cálculo:
| 25 mg Soluto | x | 1 L Solución | = | 0.25 L (250 mL) |
| 100 mg Soluto |
9. Dilución de Vertido
Una fábrica produce 2000 mg de un contaminante por hora. Si el límite legal es 5 ppm, ¿cuánta agua debe usar para diluirlo antes de verterlo?
Cálculo:
| 2000 mg Contam. | x | 1 L Agua | = | 400 L Agua |
| 5 mg Contam. |