Instrucciones
Usted tiene las siguientes opciones en este simulador para moléculas pequeñas tanto inorgánicas como orgánicas.
- En la parte superior, aparecen los botones 2D y 3D para que pueda observar el modelo en dos o tres dimensiones.
- A continuación se presenta el modelo en dos o tres dimensiones.
- "Search" puede ser utilizado para buscar alguna molécula, escribiendo el nombre en inglés, por ejemplo al escribir, sulphuric acid (ácido sulfúrico).
- Color de fondo, sirve seleccionar el color del fondo del modelo en tres dimensiones.
- Acercar +, acerca el modelo.
- Acercar -, aleja el modelo.
- Girar X, Y, Z, para girar el modelo en tres dimensiones en los ejes x, y, z.
- Alambres, varillas y pelotas y varillas, para cambiar el modelo en tres dimensiones en esas representaciones.
- Energía, aparce en la parte superior la energía de la molécula en kJ/mol o kcal/mol.
- Minmizar por MMFF94, normalmente las estructuras iniciales que se crean en los simuladores poseen energías mucho mayores a las que tendría un objeto real, por esta razón, se utilizan algoritmos para calcular las posiciones y fuerzas originales, con el objetivo de minimizarlas y que sean más realistas.
- Arrastrar Minimizar, usted puede arrastrar un átomo, soltarlo y entonces el sistema hace un cálculo de minimización de energía.
- Simetría, muestra los planos de simetría en la molécula.
- Editar, puede editar la molécula agragando o quitando átomos y enlaces.
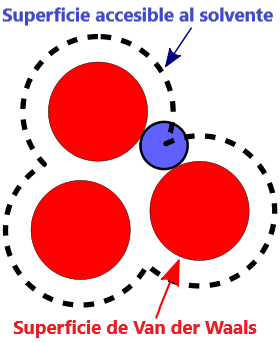
- Superficie VDW, la superficie de van der Waals de una molécula es una representación abstracta o modelo de esa molécula, que ilustra dónde, en términos muy generales, podría haber una superficie para la molécula en función de los cortes duros de los radios de van der Waals para átomos individuales, y representa una superficie a través de la cual la molécula podría concebirse interactuando con otras moléculas.
- PEM es el mapa de potencial electrostático.
- Carga parcial calcula la carga parcial de cada átomo.
- Tetraedros, para el caso que exista alguna átomo tetraédrico.
- Dipolos enlaces, para ver el los dipolos de todos los enlaces.
- Dipolo molecular, para ver el momento dipolar resultante de toda la molécula.
- Hibridación sp, sp2 y sp3, para ver la hibridacion del átomo de carbono.
- Anillo aromático, muestra los anillos aromáticos.
- Heteroátomo, muestra los heteroátomos en heterociclos.
- C quiral (nomenclatura R/S) y E/Z para isomería geométrica en alquenos, los descriptores R/S permiten indicar en un compuesto orgánico la configuración (la disposición espacial de los sustituyentes) de un carbono o centro quiral, estereocentro o centro estereogénico, que es el caso de un átomo de carbono con cuatro sustituyentes diferentes. Se añade R o S entre paréntesis como prefijo delante del nombre de la molécula orgánica. En caso de ser más de uno el centro estereogénico, separados por coma se indica el descriptor R o S de cada uno, precedido del número o localizador que identifica su posición.
- Invertir R/S, para cambiar la quiralidad.
- Nomenclatura E/Z en Alquenos, el sistema tradicional para nombrar los isómeros geométricos de un alqueno, en el que los mismos grupos están dispuestos de manera diferente, es nombrarlos como cis o trans. Sin embargo, es fácil encontrar ejemplos donde el sistema cis-trans no se aplica fácilmente.
- N electrones, O electrones y S electrones, para ver los electrones libres del nitrógeno, oxígeno y azufre.
- C primario, C secundario, C terciario, C cuaternario, identifica la clasificación de los átomos de carbono.
- Dadores y aceptores de puentes de hidrógeno, señala los átomos que pueden dar o aceptar puentes de hidrógeno
- Botón 2D, cuando escoge el botón 2D, la aplicación tiene su propio menú y quedan inhabilitados todos los botones 3D.

Escuchar Podcast
Haz clic en el botón para cargar y reproducir el audio.
Video Explicativo
Laboratorio de IA: Tu Copiloto de Estudio
Aprende a usar la Inteligencia Artificial
La IA (como ChatGPT, Gemini o Copilot) no sirve solo para darte respuestas. Úsala para entender mejor. Aquí tienes 3 "Prompts" (instrucciones) maestros para probar ahora mismo:
1. Empírico vs Valorado
Entiende la diferencia cualitativa/cuantitativa.
2. Visualizando la Mente
Imagina la concentración sin números.
3. Arquitectura Dimensional
Conectando mundos (Físico vs Químico).
Concentración de las Soluciones
¿Qué es la Concentración?
La concentración es la medida de cuánto soluto está disuelto en una cantidad específica de solvente o solución.
Imagina que preparas agua azucarada. Si agregas más azúcar (soluto) o si hierves el agua para que se evapore (menos solvente), el sabor será más dulce: la concentración aumenta.
Concepto Clave
La concentración determina las propiedades de la solución, como su color, sabor, punto de ebullición y reactividad química.
Ajusta los deslizadores para ver cómo cambia el color y el volumen.
* "C" representa un valor relativo de concentración.
Clasificación Cualitativa
Antes de medir con números exactos, a menudo describimos las soluciones comparativamente:
Unidades de Concentración
Para la ciencia y la industria, "diluido" no es suficiente. Necesitamos números exactos. Las unidades se dividen en dos grandes grupos:
Unidades Físicas
Se basan en masa y volumen. Son muy usadas en la industria alimentaria, farmacéutica y ambiental.
Unidades Químicas
Se basan en el mol. Son fundamentales para calcular reacciones químicas (estequiometría).
Importancia Crítica en la Física: Semiconductores
En física y electrónica, la concentración no es solo una medida, es la base de toda la tecnología moderna.
Los chips de computadoras y paneles solares están hechos de semiconductores (generalmente Silicio). Por sí solo, el silicio puro no conduce bien la electricidad. Para volverlo útil, los físicos agregan cantidades minúsculas de otros átomos (como Fósforo o Boro) en un proceso llamado Dopaje.
La concentración de estos "dopantes" es increíblemente baja, a menudo en el rango de Partes por Millón (ppm) o incluso Partes por Billón (ppb), ¡pero es suficiente para aumentar la conductividad eléctrica del material por un factor de miles!
La Magia del Dopaje
1 átomo de impureza por cada 100 millones de átomos de silicio puede cambiar un aislante
en un conductor.
Reflexión
Sin el control preciso de estas concentraciones infinitesimales, no existirían los transistores, ni los smartphones, ni internet.
La Física de las Soluciones: Tecnología y Materiales
La composición no es solo un concepto químico; es la base de la tecnología moderna y la ingeniería de materiales.
Semiconductores (Dopaje)
Los chips de tu celular y computadora están hechos de Silicio.
Para que funcionen, se agregan cantidades minúsculas de otros elementos (como Fósforo o Boro). Este proceso se llama Dopaje.
Impacto: Una variación de apenas 1 átomo por cada millón cambia al material de aislante a conductor, permitiendo crear transistores y toda la electrónica digital.
Aleaciones (Soluciones Sólidas)
Muchos metales que usamos no son puros, sino soluciones sólidas.
El Acero, por ejemplo, es una solución de Carbono disuelto en Hierro.
Impacto: Cambiando ligeramente el porcentaje de Carbono (composición), obtenemos materiales con distinta dureza, elasticidad y resistencia a la corrosión.
Importancia Médica de la Concentración
En medicina, la concentración es vital. Una diferencia incorrecta de concentración entre una solución intravenosa y la sangre puede destruir los glóbulos rojos por ósmosis.
Isotónica
Misma concentración que el interior celular (ej. Suero Salino 0.9%).
Efecto: Equilibrio. La célula mantiene su forma ideal.
Hipertónica
Más concentrada que la célula (ej. Agua de mar).
Efecto: El agua sale de la célula. Se arruga y deshidrata (Crenación).
Hipotónica
Menos concentrada que la célula (ej. Agua destilada).
Efecto: El agua entra a la célula. Se hincha y puede explotar (Hemólisis).
Concentración en la Dosificación de Medicamentos
La concentración de un fármaco (ej. mg/mL en un jarabe) es crítica. Una pequeña variación puede diferenciar entre la cura y un efecto tóxico.
El Margen Terapéutico
Es el rango de concentración en sangre donde el medicamento es eficaz sin ser tóxico.
- Concentración Subterapéutica: Dosis muy baja. No cura (Ineficaz).
- Concentración Tóxica: Dosis muy alta. Causa efectos secundarios graves o muerte.
Ejemplo Práctico
Un jarabe pediátrico suele tener una concentración de 100 mg/5 mL.
Si por error se usa la versión de adultos (250 mg/5 mL), un niño recibiría 2.5 veces la dosis correcta en la misma cucharada, provocando una sobredosis inmediata.
Video: Introducción a las Soluciones

Resumen: Composición de Soluciones
1. Componentes
2. Clasificación por Cantidad de Soluto
Diluida
Muy poco soluto.
Concentrada
Cantidad considerable de soluto.
Saturada
Máximo soluto que el solvente puede disolver.
Sobresaturada
Exceso de soluto (inestable).
3. Unidades de Concentración
Unidades Físicas
| Unidad | Fórmula |
|---|---|
| % m/m | (Masa Soluto / Masa Solución) x 100 |
| % v/v | (Vol Soluto / Vol Solución) x 100 |
| % m/v | (Masa Soluto / Vol Solución) x 100 |
| ppm | mg Soluto / L Solución |
Unidades Químicas
| Unidad | Fórmula | Símbolo |
|---|---|---|
| Molaridad | Moles Soluto / Litros Solución | M |
| Normalidad | Equivalentes Soluto / Litros Solución | N |
| Molalidad | Moles Soluto / Kilogramos Solvente | m |
Presentación de la Clase
Para mejor experiencia en celular, abre la guía directamente:
Abrir PDFLa presentación contiene gráficas de alta calidad.