Instrucciones
Usted tiene las siguientes opciones en este simulador para moléculas pequeñas tanto inorgánicas como orgánicas.
- En la parte superior, aparecen los botones 2D y 3D para que pueda observar el modelo en dos o tres dimensiones.
- A continuación se presenta el modelo en dos o tres dimensiones.
- "Search" puede ser utilizado para buscar alguna molécula, escribiendo el nombre en inglés, por ejemplo al escribir, sulphuric acid (ácido sulfúrico).
- Color de fondo, sirve seleccionar el color del fondo del modelo en tres dimensiones.
- Acercar +, acerca el modelo.
- Acercar -, aleja el modelo.
- Girar X, Y, Z, para girar el modelo en tres dimensiones en los ejes x, y, z.
- Alambres, varillas y pelotas y varillas, para cambiar el modelo en tres dimensiones en esas representaciones.
- Energía, aparce en la parte superior la energía de la molécula en kJ/mol o kcal/mol.
- Minmizar por MMFF94, normalmente las estructuras iniciales que se crean en los simuladores poseen energías mucho mayores a las que tendría un objeto real, por esta razón, se utilizan algoritmos para calcular las posiciones y fuerzas originales, con el objetivo de minimizarlas y que sean más realistas.
- Arrastrar Minimizar, usted puede arrastrar un átomo, soltarlo y entonces el sistema hace un cálculo de minimización de energía.
- Simetría, muestra los planos de simetría en la molécula.
- Editar, puede editar la molécula agragando o quitando átomos y enlaces.
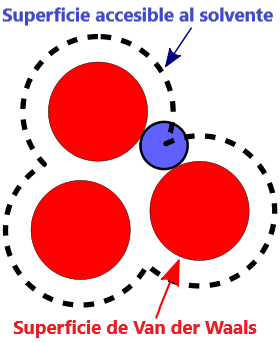
- Superficie VDW, la superficie de van der Waals de una molécula es una representación abstracta o modelo de esa molécula, que ilustra dónde, en términos muy generales, podría haber una superficie para la molécula en función de los cortes duros de los radios de van der Waals para átomos individuales, y representa una superficie a través de la cual la molécula podría concebirse interactuando con otras moléculas.
- PEM es el mapa de potencial electrostático.
- Carga parcial calcula la carga parcial de cada átomo.
- Tetraedros, para el caso que exista alguna átomo tetraédrico.
- Dipolos enlaces, para ver el los dipolos de todos los enlaces.
- Dipolo molecular, para ver el momento dipolar resultante de toda la molécula.
- Hibridación sp, sp2 y sp3, para ver la hibridacion del átomo de carbono.
- Anillo aromático, muestra los anillos aromáticos.
- Heteroátomo, muestra los heteroátomos en heterociclos.
- C quiral (nomenclatura R/S) y E/Z para isomería geométrica en alquenos, los descriptores R/S permiten indicar en un compuesto orgánico la configuración (la disposición espacial de los sustituyentes) de un carbono o centro quiral, estereocentro o centro estereogénico, que es el caso de un átomo de carbono con cuatro sustituyentes diferentes. Se añade R o S entre paréntesis como prefijo delante del nombre de la molécula orgánica. En caso de ser más de uno el centro estereogénico, separados por coma se indica el descriptor R o S de cada uno, precedido del número o localizador que identifica su posición.
- Invertir R/S, para cambiar la quiralidad.
- Nomenclatura E/Z en Alquenos, el sistema tradicional para nombrar los isómeros geométricos de un alqueno, en el que los mismos grupos están dispuestos de manera diferente, es nombrarlos como cis o trans. Sin embargo, es fácil encontrar ejemplos donde el sistema cis-trans no se aplica fácilmente.
- N electrones, O electrones y S electrones, para ver los electrones libres del nitrógeno, oxígeno y azufre.
- C primario, C secundario, C terciario, C cuaternario, identifica la clasificación de los átomos de carbono.
- Dadores y aceptores de puentes de hidrógeno, señala los átomos que pueden dar o aceptar puentes de hidrógeno
- Botón 2D, cuando escoge el botón 2D, la aplicación tiene su propio menú y quedan inhabilitados todos los botones 3D.

Escuchar Podcast
Haz clic en el botón para cargar y reproducir el audio.
El Agua: La Molécula Anómala
El agua es más que un simple líquido; es una sustancia anómala que desafía las reglas. Es la única sustancia que se encuentra naturalmente en los tres estados de la materia en la Tierra, y sus propiedades únicas son el fundamento de la vida tal como la conocemos.
¿Por qué es tan especial?
Para entender sus "superpoderes" macroscópicos —como escalar árboles altos o disolver rocas— debemos mirar primero lo invisible: su extraña y geometría estructura molecular.
Video con Descarga Progresiva Optimizada
Laboratorio de IA: Tu Copiloto de Estudio
Aprende a usar la Inteligencia Artificial
La IA (como ChatGPT, Gemini o Copilot) no sirve solo para darte respuestas. Úsala para entender mejor. Aquí tienes 3 "Prompts" (instrucciones) maestros para probar ahora mismo:
1. El "Traductor" de Propiedades
Para entender por qué el agua es única.
2. Conexión con la Vida
Aplicación biológica inmediata.
3. El Tutor Socrático
Para razonar sobre solubilidad.
1. El Origen: Una Estructura Polar
La molécula de agua (H2O) presenta las siguientes características fundamentales:
- Tiene una (angular).
- Su geometría electrónica corresponde a una forma .
- El H-O-H es de 104.5° y el oxígeno tiene dos pares de . .
- La molécula posee , una carga parcial positiva (δ+) sobre cada hidrógeno y una carga parcial negativa (δ-) sobre el oxígeno.
- El átomo de oxígeno presenta una .
Debido a que el oxígeno es un "abusivo" con los electrones (muy electronegativo), se queda con la mayor parte de la carga negativa. Esto crea dos polos:
- Polo Negativo (δ-): Cerca del oxígeno.
- Polo Positivo (δ+): Cerca de los hidrógenos.
¡El agua es como un pequeño imán! Esta propiedad se llama polaridad.
Modelo Orbital
Desde el núcleo de oxígeno se ramifican cuatro orbitales constituyendo un tetraedro hipotético. Dos orbitales enlazan a los hidrógenos, y los otros dos contienen electrones no compartidos (zona negativa). Esta geometría es clave para entender por qué el agua se comporta como lo hace.

Podemos ver esta "carga" en acción con el experimento de las varillas cargadas electricamente:
Agua (Muy Polar)
¡La corriente de agua se desvía fuertemente!
Etanol (Algo Polar)
Se desvía, pero con menos fuerza.
Hexano (No Polar)
No ocurre nada. El hexano ignora a la varilla.
2. La Consecuencia: Puentes de Hidrógeno
Como el agua es polar, el lado positivo de una molécula atrae al lado negativo de la vecina. Esta atracción se llama Puente de Hidrógeno.
El Secreto de la Fortaleza Colectiva
Imagina estos puentes como un "velcro molecular". Un solo puente es débil y efímero (se rompe en picosegundos), permitiendo que el agua fluya. Pero la suma simultánea de billones de ellos crea una estructura interna increíblemente cohesiva y resistente.
Esta red dinámica explica propiedades vitales:
- Cohesión: Mantiene el agua unida (gotas esféricas).
- Adhesión: Permite que el agua "trepe" por superficies (capilaridad en plantas).
- Estabilidad: Hace difícil cambiar su temperatura o estado (protección térmica).

Las líneas punteadas son los puentes de hidrógeno formándose y rompiéndose constantemente.
3. El Impacto: Propiedades Macroscópicas
Gracias a su estructura y a los puentes de hidrógeno, el agua tiene comportamientos únicos fundamentales para la vida:
1. Alta Tensión Superficial
Es la fuerza que ejerce el líquido sobre su superficie. Las moléculas superficiales son atraídas hacia adentro, creando una "piel". Disminuye con la temperatura (al aumentar la agitación térmica) y es vital para fenómenos biológicos.
2. Elevada Cohesión Molecular
Permite al agua dar volumen a las células (turgencia en plantas) y actuar como esqueleto hidrostático en invertebrados. También funciona como amortiguador mecánico en articulaciones (líquido sinovial), evitando el roce entre huesos.
3. Elevada Capacidad Disolvente
El agua es el solvente universal para iones y moléculas polares (hidrofílicas).
Rodea a los iones (como Na+ y Cl-) formando capas de hidratación que impiden su
unión.
Esto se debe a su elevada constante dieléctrica (aprox. 80 a 20°C).
¿Qué es esto? Imagina que es como un "escudo aislante".
Si dos imanes (iones) se atraen con fuerza en el aire, dentro del agua esa fuerza se reduce 80
veces.
El agua debilita la atracción eléctrica, permitiendo que las partículas se separen y floten
libremente.

Simulación: El Proceso de Disolución
¿Cómo interactúa el agua realmente con la materia?
En esta simulación, exploraremos los mecanismos moleculares que determinan si una sustancia se disuelve o no. La clave está en la polaridad: el agua es exigente y sólo interactúa con partículas que tengan carga (iones) o grupos polares. Haz clic en las pestañas para ver cuatro casos fundamentales:
4. Propiedades Térmicas: Escudo y Refrigeración
1. Amortiguador Térmico (Alto Calor Específico):
¿Por qué no "hervimos" al hacer ejercicio intenso?
El agua absorbe grandes cantidades de calor metabólico sin aumentar drásticamente su temperatura.
Esto es vital para la homeostasis, protegiendo a las enzimas y proteínas celulares de
cambios bruscos de temperatura que podrían desnaturalizarlas.
2. Mecanismo de Refrigeración (Alto Calor de Vaporización):
Cuando la temperatura corporal sube (fiebre o deporte), sudamos.
Para evaporar el sudor, el cuerpo debe "gastar" mucha energía calorífica (540 cal/g).
Al romperse los puentes de hidrógeno para pasar a gas, el agua se lleva ese exceso de calor, enfriando
la piel de manera extremadamente eficiente.

El sudor absorbe calor corporal para evaporarse, enfriando la piel.
5. pH y Equilibrio Ácido-Base: La Línea entre la Vida y la Muerte
Aunque el agua pura es neutra (pH 7.0), en el cuerpo humano el pH es ligeramente alcalino.
El pH Sanguíneo (7.35 - 7.45): Es una de las constantes fisiológicas más estrictas.
Una variación de tan solo 0.4 unidades (bajar a 7.0 o subir a 7.8) es incompatible con la vida,
causando Acidosis o Alcalosis letal.
Sistemas Amortiguadores (Buffers): Para evitar esto, el cuerpo usa sistemas como el Bicarbonato que "secuestran" o liberan protones (H+) instantáneamente, manteniendo el equilibrio químico necesario para que nuestras células funcionen.
2H2O ⇌ H3O+ + OH-
(Kw = 1.0 x 10-14 a 25°C)

Rango vital del pH sanguíneo y zonas de riesgo.
4. El Agua en el Cuerpo Humano
El agua no es solo un relleno; es el medio donde ocurre la vida. Sus funciones fisiológicas principales son:
1. Medio de Transporte (Sangre)
La sangre es 90% agua. Funciona como una "autopista" líquida que transporta:
- Oxígeno y Nutrientes a las células.
- Hormonas y señales químicas.
- Células inmunes para defensa.
2. Sistema de Excreción (Riñones)
El agua es vital para "lavar" el cuerpo. Los riñones filtran la sangre y usan agua para diluir y expulsar toxinas (urea) a través de la orina, previniendo intoxicaciones.
3. Reactivo Químico (Hidrólisis)
En la digestión, el agua actúa como una "tijera molecular".
Las enzimas digestivas utilizan moléculas de agua para romper los enlaces químicos de los alimentos
(Hidrólisis).
Por ejemplo, convierten cadenas largas de almidón en glucosa simple, o proteínas en aminoácidos,
permitiendo que estos nutrientes crucen la pared intestinal y entren a la sangre.
Sin agua, simplemente no podríamos nutrirnos.

4. Lubricante y Amortiguador
El agua crea capas fluidas que evitan el roce directo entre tejidos, previniendo lesiones graves:
- Protección Articular: Forma el líquido sinovial, que lubrica rodillas y codos como si fuera "aceite", evitando que los huesos rechinen y se desgasten.
- Escudo Cerebral: El cerebro flota en el líquido cefalorraquídeo, que amortigua golpes contra el cráneo.
- Barreras Mucosas: Mantiene húmedas las vías respiratorias y digestivas, atrapando polvo y bacterias.


5. Resumen Visual
Sintetizando los conceptos clave del agua.

Presentación Resumida
Para mejor experiencia en celular, abre la guía directamente:
Abrir Guía PDFLa presentación contiene gráficas de alta calidad.



