Instrucciones
Usted tiene las siguientes opciones en este simulador para moléculas pequeñas tanto inorgánicas como orgánicas.
- En la parte superior, aparecen los botones 2D y 3D para que pueda observar el modelo en dos o tres dimensiones.
- A continuación se presenta el modelo en dos o tres dimensiones.
- "Search" puede ser utilizado para buscar alguna molécula, escribiendo el nombre en inglés, por ejemplo al escribir, sulphuric acid (ácido sulfúrico).
- Color de fondo, sirve seleccionar el color del fondo del modelo en tres dimensiones.
- Acercar +, acerca el modelo.
- Acercar -, aleja el modelo.
- Girar X, Y, Z, para girar el modelo en tres dimensiones en los ejes x, y, z.
- Alambres, varillas y pelotas y varillas, para cambiar el modelo en tres dimensiones en esas representaciones.
- Energía, aparce en la parte superior la energía de la molécula en kJ/mol o kcal/mol.
- Minmizar por MMFF94, normalmente las estructuras iniciales que se crean en los simuladores poseen energías mucho mayores a las que tendría un objeto real, por esta razón, se utilizan algoritmos para calcular las posiciones y fuerzas originales, con el objetivo de minimizarlas y que sean más realistas.
- Arrastrar Minimizar, usted puede arrastrar un átomo, soltarlo y entonces el sistema hace un cálculo de minimización de energía.
- Simetría, muestra los planos de simetría en la molécula.
- Editar, puede editar la molécula agragando o quitando átomos y enlaces.
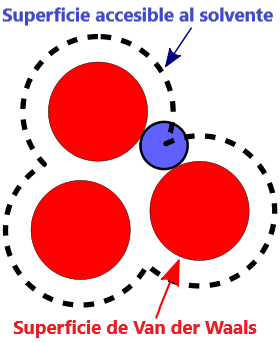
- Superficie VDW, la superficie de van der Waals de una molécula es una representación abstracta o modelo de esa molécula, que ilustra dónde, en términos muy generales, podría haber una superficie para la molécula en función de los cortes duros de los radios de van der Waals para átomos individuales, y representa una superficie a través de la cual la molécula podría concebirse interactuando con otras moléculas.
- PEM es el mapa de potencial electrostático.
- Carga parcial calcula la carga parcial de cada átomo.
- Tetraedros, para el caso que exista alguna átomo tetraédrico.
- Dipolos enlaces, para ver el los dipolos de todos los enlaces.
- Dipolo molecular, para ver el momento dipolar resultante de toda la molécula.
- Hibridación sp, sp2 y sp3, para ver la hibridacion del átomo de carbono.
- Anillo aromático, muestra los anillos aromáticos.
- Heteroátomo, muestra los heteroátomos en heterociclos.
- C quiral (nomenclatura R/S) y E/Z para isomería geométrica en alquenos, los descriptores R/S permiten indicar en un compuesto orgánico la configuración (la disposición espacial de los sustituyentes) de un carbono o centro quiral, estereocentro o centro estereogénico, que es el caso de un átomo de carbono con cuatro sustituyentes diferentes. Se añade R o S entre paréntesis como prefijo delante del nombre de la molécula orgánica. En caso de ser más de uno el centro estereogénico, separados por coma se indica el descriptor R o S de cada uno, precedido del número o localizador que identifica su posición.
- Invertir R/S, para cambiar la quiralidad.
- Nomenclatura E/Z en Alquenos, el sistema tradicional para nombrar los isómeros geométricos de un alqueno, en el que los mismos grupos están dispuestos de manera diferente, es nombrarlos como cis o trans. Sin embargo, es fácil encontrar ejemplos donde el sistema cis-trans no se aplica fácilmente.
- N electrones, O electrones y S electrones, para ver los electrones libres del nitrógeno, oxígeno y azufre.
- C primario, C secundario, C terciario, C cuaternario, identifica la clasificación de los átomos de carbono.
- Dadores y aceptores de puentes de hidrógeno, señala los átomos que pueden dar o aceptar puentes de hidrógeno
- Botón 2D, cuando escoge el botón 2D, la aplicación tiene su propio menú y quedan inhabilitados todos los botones 3D.
Laboratorio de IA: Tu Copiloto de Estudio
Aprende a usar la Inteligencia Artificial
La IA (como ChatGPT, Gemini o Copilot) no sirve solo para darte respuestas. Úsala para entender mejor. Aquí tienes 3 "Prompts" (instrucciones) maestros para probar ahora mismo:
1. El "Traductor" de Conceptos
Úsalo cuando la teoría sea confusa.
2. El Generador de Retos
Para practicar antes del examen.
3. El Tutor Socrático
Cuando te trabes en un ejercicio.
Soluciones

Podcast: Entendiendo la Molaridad
Escucha la explicación conceptual sobre Moles y Volumen de Solución.
Video Explicativo
Presentación Resumida
Para mejor experiencia en celular, abre la guía directamente:
Abrir Guía PDFVisualiza las diapositivas clave del tema.
Infografía Resumen

Guía visual rápida sobre conceptos clave.
Antes de empezar...
Para dominar este tema, asegúrate de tener claros estos conceptos:
- El Mol: La unidad fundamental de cantidad en química.
- Masa Molar (Peso Fórmula): Cómo sumar las masas atómicas (g/mol). [Ir a Calculadora]
- Unidades de Volumen: Recuerda que 1000 mL = 1 L. La definición es mol/L, aunque numéricamente equivale a mmol/mL.
Futuros Médicos
¿Por qué importa? Imagina a un paciente deshidratado. Debes administrarle solución salina al 0.9% (NaCl 0.154 M). Un error en la molaridad podría causar un shock osmótico fatal.
La molaridad no es solo una fórmula; es la base de la farmacología y la vida.
Futuros Docentes
Nota Pedagógica: La molaridad es un ejemplo perfecto de razonamiento proporcional.
No se centren solo en el "resultado". Enseñen a sus alumnos a distinguir entre las variables (moles vs litros) y la relación que las une (concentración). Usemos analogías como "la fuerza del café".
Laboratorio de Molaridad
A continuación, resolveremos 3 tipos de problemas clave. Intenta resolverlos tú mismo antes de ver la solución.
Tipo 1: Calculando Molaridad (M)
Calcule la molaridad de una solución preparada disolviendo 1.50 g de Nitrato de sodio (NaNO3) en 125 mL de solución.
Ver solo respuesta finalCálculo (Factor Unitario)
| 1.50 g NaNO3 | x | 1 mol | x | 1000 mL | = | 0.141 M |
| 125 mL Solución | 85.0 g NaNO3 | 1 L |
Médica: Suero Fisiológico
9.0 g NaCl en 1 L = 0.154 M.
Tipo 2: Calculando Masa (Preparación)
Calcule la masa de KOH necesaria para preparar 625 mL de solución 0.350 M.
Tipo 3: Calculando Volumen (Dosificación)
Calcule el volumen de solución 0.525 M que se puede preparar con 11.5 g de K2CO3.
Errores Comunes
- Volumen en mL: ¡Nunca uses mililitros en la fórmula de Molaridad! Siempre convierte a Litros.
- Molaridad (M) vs Molalidad (m):
- Molaridad (M) = moles / Litros de Solución (depende de la temperatura).
- Molalidad (m) = moles / kg de Solvente (NO depende de la temperatura).
Un café "fuerte" tiene más soluto (café) en el mismo volumen de agua. Agregar más agua sin agregar café diluye la solución (baja la molaridad), pero la cantidad de moles de cafeína sigue siendo la misma.
Pon a prueba tus conocimientos con estos 9 desafíos. Intenta resolverlos antes de ver la solución.
I. Calculando Molaridad (M)
1. Café Azucarado
Si agregas 5.0 g de azúcar (C12H22O11), MM = 342.3 g/mol) a tu taza de café y el volumen final es de 250 mL, ¿cuál es la molaridad del azúcar en tu café?
1. Datos: masa = 5.0 g | MM = 342.3 g/mol | V = 250 mL
2. Cálculo (Factor Unitario):
| 5.0 g C12H22O11 | x | 1 mol C12H22O11 | x | 1000 mL | = 0.058 M |
| 342.3 g C12H22O11 | 250 mL Solución |
2. Ácido Estomacal
El jugo gástrico contiene HCl (MM = 36.46 g/mol). Si una muestra de 10.0 mL contiene 0.036 g de HCl, calcule su molaridad.
1. Datos: masa = 0.036 g | MM = 36.46 g/mol | V = 10.0 mL
2. Cálculo:
| 0.036 g HCl | x | 1 mol HCl | x | 1000 mL | = 0.099 M |
| 36.46 g HCl | 10 mL Solución |
3. Soda Cáustica Industrial
Para fabricar jabón se disuelven 400 g de NaOH (MM = 40.0 g/mol) en suficiente agua para hacer 2.0 Litros de solución. ¿Cuál es la concentración molar?
1. Datos: masa = 400 g | MM = 40.0 g/mol | V = 2.0 L
2. Cálculo:
| 400 g NaOH | x | 1 mol NaOH | = 5.0 M |
| 2.0 L Solución | 40.0 g NaOH |
II. Calculando Masa (g)
1. Nitrato de Plata (Lab)
Necesitas preparar 500 mL de una solución de AgNO3 (MM = 169.87 g/mol) con concentración 0.100 M para una titulación. ¿Cuántos gramos debes pesar?
Cálculo paso a paso:
| 500 mL Sol | x | 1 L | x | 0.100 mol AgNO3 | x | 169.87 g AgNO3 | = 8.49 g AgNO3 |
| 1000 mL | 1 L Sol | 1 mol AgNO3 |
2. Fertilizante Urea
Un agricultor desea preparar 10.0 L de una solución de urea CO(NH2)2 (MM = 60.06 g/mol) al 2.0 M. ¿Cuánta urea necesita?
| 10.0 L Sol | x | 2.0 mol Urea | x | 60.06 g Urea | = 1201.2 g (1.2 kg) |
| 1 L Sol | 1 mol Urea |
3. Baño de Cobre
Para un baño electrolítico se requieren 250 mL de CuSO4 (MM = 159.6 g/mol) 0.5 M. Calcule la masa necesaria.
| 0.250 L Sol | x | 0.5 mol CuSO4 | x | 159.6 g CuSO4 | = 19.95 g CuSO4 |
| 1 L Sol | 1 mol CuSO4 |
III. Calculando Volumen (mL o L)
1. Ácido Sulfúrico (Seguridad)
Tienes 19.6 g de H2SO4 (MM = 98.08 g/mol). ¿Qué volumen de solución debes preparar para que la concentración sea exactamente 2.0 M?
| 19.6 g H2SO4 | x | 1 mol H2SO4 | x | 1000 mL Sol | = 100 mL Solución |
| 98.08 g H2SO4 | 2.0 mol H2SO4 |
2. Dosis Pediátrica (Antibiótico)
Un antibiótico tiene una concentración de 0.125 M. Si el médico receta administrar 1.0 mmol (0.001 mol) del medicamento, ¿cuántos mL se deben inyectar?
| 1.0 mmol Farmaco | x | 1 mL Sol | = 8.0 mL |
| 0.125 mmol Farmaco | |||
| Nota: M = mol/L = mmol/mL | |||
3. Buffer Tris (Biotech)
Se dispone de 6.057 g de Tris base (MM = 121.14 g/mol). Se desea preparar una solución buffer 0.05 M. ¿Cuál será el volumen final?
| 6.057 g Tris | x | 1 mol Tris | x | 1 L Sol | = 1.0 L Solución |
| 121.14 g Tris | 0.05 mol Tris |