Instrucciones
Usted tiene las siguientes opciones en este simulador para moléculas pequeñas tanto inorgánicas como orgánicas.
- En la parte superior, aparecen los botones 2D y 3D para que pueda observar el modelo en dos o tres dimensiones.
- A continuación se presenta el modelo en dos o tres dimensiones.
- "Search" puede ser utilizado para buscar alguna molécula, escribiendo el nombre en inglés, por ejemplo al escribir, sulphuric acid (ácido sulfúrico).
- Color de fondo, sirve seleccionar el color del fondo del modelo en tres dimensiones.
- Acercar +, acerca el modelo.
- Acercar -, aleja el modelo.
- Girar X, Y, Z, para girar el modelo en tres dimensiones en los ejes x, y, z.
- Alambres, varillas y pelotas y varillas, para cambiar el modelo en tres dimensiones en esas representaciones.
- Energía, aparce en la parte superior la energía de la molécula en kJ/mol o kcal/mol.
- Minmizar por MMFF94, normalmente las estructuras iniciales que se crean en los simuladores poseen energías mucho mayores a las que tendría un objeto real, por esta razón, se utilizan algoritmos para calcular las posiciones y fuerzas originales, con el objetivo de minimizarlas y que sean más realistas.
- Arrastrar Minimizar, usted puede arrastrar un átomo, soltarlo y entonces el sistema hace un cálculo de minimización de energía.
- Simetría, muestra los planos de simetría en la molécula.
- Editar, puede editar la molécula agragando o quitando átomos y enlaces.
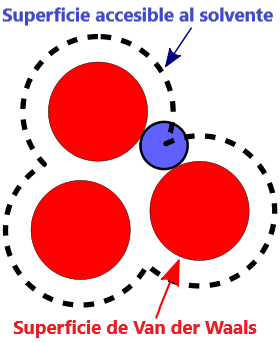
- Superficie VDW, la superficie de van der Waals de una molécula es una representación abstracta o modelo de esa molécula, que ilustra dónde, en términos muy generales, podría haber una superficie para la molécula en función de los cortes duros de los radios de van der Waals para átomos individuales, y representa una superficie a través de la cual la molécula podría concebirse interactuando con otras moléculas.
- PEM es el mapa de potencial electrostático.
- Carga parcial calcula la carga parcial de cada átomo.
- Tetraedros, para el caso que exista alguna átomo tetraédrico.
- Dipolos enlaces, para ver el los dipolos de todos los enlaces.
- Dipolo molecular, para ver el momento dipolar resultante de toda la molécula.
- Hibridación sp, sp2 y sp3, para ver la hibridacion del átomo de carbono.
- Anillo aromático, muestra los anillos aromáticos.
- Heteroátomo, muestra los heteroátomos en heterociclos.
- C quiral (nomenclatura R/S) y E/Z para isomería geométrica en alquenos, los descriptores R/S permiten indicar en un compuesto orgánico la configuración (la disposición espacial de los sustituyentes) de un carbono o centro quiral, estereocentro o centro estereogénico, que es el caso de un átomo de carbono con cuatro sustituyentes diferentes. Se añade R o S entre paréntesis como prefijo delante del nombre de la molécula orgánica. En caso de ser más de uno el centro estereogénico, separados por coma se indica el descriptor R o S de cada uno, precedido del número o localizador que identifica su posición.
- Invertir R/S, para cambiar la quiralidad.
- Nomenclatura E/Z en Alquenos, el sistema tradicional para nombrar los isómeros geométricos de un alqueno, en el que los mismos grupos están dispuestos de manera diferente, es nombrarlos como cis o trans. Sin embargo, es fácil encontrar ejemplos donde el sistema cis-trans no se aplica fácilmente.
- N electrones, O electrones y S electrones, para ver los electrones libres del nitrógeno, oxígeno y azufre.
- C primario, C secundario, C terciario, C cuaternario, identifica la clasificación de los átomos de carbono.
- Dadores y aceptores de puentes de hidrógeno, señala los átomos que pueden dar o aceptar puentes de hidrógeno
- Botón 2D, cuando escoge el botón 2D, la aplicación tiene su propio menú y quedan inhabilitados todos los botones 3D.
Laboratorio de IA: Tu Copiloto de Estudio
Aprende a usar la Inteligencia Artificial
La IA (como ChatGPT, Gemini o Copilot) no sirve solo para darte respuestas. Úsala para entender mejor. Aquí tienes 3 "Prompts" (instrucciones) maestros para probar ahora mismo:
1. Más allá de lo Básico
Análisis de mezclas complejas.
2. Mecánica Molecular
Energía Cinética y Colisiones.
3. Fuerzas Intermoleculares
La física detrás de la disolución.
Soluciones

Podcast: Introducción a Soluciones
Video Resumen: Definición de Soluciones
Presentación Resumida
Para mejor experiencia en celular, abre la guía directamente:
Abrir Guía PDFLa presentación contiene gráficas de alta calidad.
¿Un misterio en el desayuno?
¿Alguna vez te has preguntado por qué el azúcar desaparece en tu café, pero si le echas aceite a tu ensalada se queda flotando por encima del vinagre? Son dos líquidos, ¿por qué no se mezclan igual? Esa pregunta, que parece tan cotidiana, es la puerta de entrada para entender las soluciones.
Para resolver este misterio, necesitamos dos herramientas clave: soluto y disolvente. Ya no son solo definiciones de libro, son las pistas. En tu café, el azúcar es el soluto (la sustancia que se disuelve) y el café es el disolvente (el medio que disuelve). Cuando el azúcar desaparece y todo el líquido se ve uniforme, decimos que hemos creado una mezcla homogénea o solución.
Partes de una solución: Soluto y Disolvente
Como vimos, en una solución siempre hay dos protagonistas. El disolvente (generalmente el más abundante) y el soluto (el que está en menor proporción). Por ejemplo, en una solución salina al 2%, la sal es nuestro soluto y el agua el disolvente que la acoge.
Solubilidad: El Superpoder Químico
Hagamos de científicos en nuestra propia cocina. Imagina que tienes tres vasos, cada uno con 100 ml de agua pura. Añades azúcar al primero, alcohol al segundo y aceite de cocina al tercero. Piénsalo un segundo: ¿Qué crees que pasará en cada caso? ¿Por qué?
Ahora, investiguemos la ciencia detrás de tu predicción. Mira la Figura 1A. Observa los vasos etiquetados como 1 (Azúcar) y 2 (Alcohol). ¿Ves cómo se integran perfectamente creando mezclas uniformes? Como no podemos distinguir sus componentes, confirmamos que son mezclas homogéneas (soluciones). Pero fíjate en el vaso 3 (Aceite): ¡se niega a mezclarse! Crea dos capas claramente separadas, por lo que decimos que es una mezcla heterogénea. Aquí entra en juego la solubilidad. Las sustancias de los vasos 1 y 2 disuelven porque son solubles, mientras que el aceite del vaso 3 es insoluble (o inmiscible).

Figura 1A
Sigamos investigando. Observa la Figura 1B. En el vaso 1 (Azúcar), el agua dijo "basta". A 20°C, solo puede disolver 204 gramos por cada 100 ml. El resto se va al fondo, haciéndola una mezcla heterogénea. Hemos encontrado el límite de solubilidad. En el vaso 2 (Aceite), nada ha cambiado: sigue sin mezclarse (heterogénea). Pero mira el vaso 3 (Alcohol): ¡Sigue siendo una solución perfecta! No importa cuánto alcohol añadas, el agua y el alcohol son tan amigos que se mezclan en cualquier proporción (son completamente miscibles).

Figura 1B
La Tabla 1 no es solo una lista, es un mapa de comportamientos. Echa un vistazo. Busca el Cloruro de sodio (sal de mesa) y mira su solubilidad: 35.7 gramos. Ahora compárala con el Nitrato de amonio: 118.3 gramos. ¡Es más del triple! ¿Qué nos dice esta enorme diferencia sobre la personalidad química de estas sustancias? A veces no necesitamos tanta precisión, y usamos términos más generales como los de la Tabla 2.
⚡ Velocidad vs Solubilidad: ¡No te confundas!
Es común pensar que si revolvemos muy rápido el café, podremos disolver más azúcar. ¡Falso!
- Agitación (Revolver): Ayuda a que el soluto se disuelva más rápido porque dispersa las partículas, pero NO cambia la cantidad máxima (solubilidad) que se puede disolver. Si echas 300g de azúcar en el vaso 1 de la Figura 1B, por más que revuelvas, 96g se irán al fondo.
- Tamaño de partícula (Triturar): El azúcar glass se disuelve más rápido que los terrones porque tiene más superficie de contacto con el agua, pero el límite de 204g sigue siendo el mismo.
La única forma de cambiar realmente la solubilidad (el límite) es cambiando la temperatura o la presión (en gases).

Tabla 1
Solubilidad en agua a diferentes temperaturas (g soluto / 100 ml H2O)
Esta tabla te permite ver tendencias e interpolar datos (estimar valores intermedios).
| Sustancia | Fórmula | 0°C | 20°C | 40°C | 60°C | 80°C | 100°C | Tendencia |
|---|---|---|---|---|---|---|---|---|
| Cloruro de sodio | NaCl | 35.7 | 36.0 | 36.6 | 37.3 | 38.4 | 39.8 | Constante |
| Nitrato de potasio | KNO3 | 13.3 | 31.6 | 63.9 | 110.0 | 169.0 | 246.0 | Aumenta muchísimo |
| Nitrato de sodio | NaNO3 | 73.0 | 88.0 | 104.0 | 124.0 | 148.0 | 180.0 | Aumenta |
| Cloruro de potasio | KCl | 27.6 | 34.0 | 40.0 | 45.5 | 51.1 | 56.7 | Aumenta moderadamente |
| Sacarosa (Azúcar) | C12H22O11 | 179 | 204 | 238 | 287 | 362 | 487 | Muy soluble (Aumenta) |
| Sulfato de cerio (III) | Ce2(SO4)3 | 21.4 | 9.8 | 5.6 | 3.9 | 2.8 | < 2.0 | Disminuye (Excepción) |
Tabla 2
Términos descriptivos de solubilidad (Referencia: Farmacopea/Wikipedia)
| Término descriptivo | Partes de disolvente para 1 parte de soluto | Rango aproximado (g soluto / 100 ml) |
|---|---|---|
| Muy soluble | Menos de 1 | Mayor a 100 |
| Libremente soluble | De 1 a 10 | 10 - 100 |
| Soluble | De 10 a 30 | 3.3 - 10 |
| Poco soluble | De 30 a 100 | 1 - 3.3 |
| Ligeramente soluble | De 100 a 1000 | 0.1 - 1 |
| Muy ligeramente soluble | De 1000 a 10,000 | 0.01 - 0.1 |
| Prácticamente insoluble | Más de 10,000 | Menor a 0.01 |
🧪 Verificador de Solubilidad
Ingresa una fórmula química para verificar su solubilidad según las reglas estándar (Wikipedia).
Prueba con:
Datos basados en Wikipedia Solubility Chart
Reglas de Solubilidad en Agua
| Compuestos Solubles | |
|---|---|
| Regla General | Excepciones (Insolubles) |
| Compuestos de Grupo 1 (Li+, Na+, K+, etc.) y Amonio (NH4+) | Ninguna |
| Nitratos (NO3-), Acetatos (C2H3O2-), Cloratos (ClO3-) y Percloratos (ClO4-) | Ninguna |
| Cloruros (Cl-), Bromuros (Br-) y Yoduros (I-) | Ag+, Hg22+, Pb2+ |
| Sulfatos (SO42-) | Ba2+, Pb2+, Hg22+, Sr2+ (Ca2+ y Ag+ son ligeramente solubles) |
| Compuestos Insolubles | |
| Regla General | Excepciones (Solubles) |
| Hidróxidos (OH-) y Sulfuros (S2-) | Grupo 1, NH4+, Ca2+, Sr2+, Ba2+ |
| Carbonatos (CO32-) y Fosfatos (PO43-) | Grupo 1 y NH4+ |
¡Atención!
El solvente es el compuesto presente en mayor cantidad.
Ese límite del que hablábamos (los 204 g de azúcar) define una solución saturada. Es el punto de equilibrio donde el disolvente no admite más soluto.
¿Qué es una solución sobresaturada?
Una solución sobresaturada contiene más soluto a una temperatura determinada del necesario para formar una solución saturada. El aumento de temperatura suele aumentar la solubilidad de los sólidos en líquidos.
Por ejemplo:
- La solubilidad de la glucosa a 25 °C es de 91 g/100 ml de agua.
- La solubilidad a 50 °C es de 244 g/100 ml de agua.
Imagina el siguiente proceso:
- Si añadimos 100 g de glucosa a 100 ml de agua a 25 °C, se disuelven 91 g. En el fondo quedan nueve gramos de sólido. Tenemos una solución saturada.
- Si ahora calentamos la mezcla a 50 °C, los 9 g restantes de glucosa se disolverán. A la nueva temperatura, el límite de solubilidad es 244 g. Con sólo 100 g de glucosa disueltos, la solución ahora está insaturada.
- Si a continuación enfriamos la mezcla a 25 °C, deberían precipitar 9 g de glucosa. Si no se forman cristales, el sistema tiene más glucosa disuelta (100 g) de la que puede retener teóricamente a 25 °C (91 g). ¡Tenemos una solución sobresaturada!
Situación Inestable
Esta es una situación "tensa" para la solución. El primer paso en la formación de cristales es la nucleación, donde las moléculas del soluto se organizan para volver a ser sólido.
Un trozo de polvo o un pequeño cristal del soluto (un cristal semilla) proporciona una plantilla para que el exceso de soluto cristalice de golpe.
Una vez que los cristales comienzan a formarse, su superficie aumenta a medida que crecen. Esto atrae más moléculas y promueve el crecimiento a un ritmo cada vez mayor hasta que la solución se estabiliza de nuevo.

Dificultades en el Laboratorio: El Reto del KNO3
Lograr una solución sobresaturada estable es una lucha contra la termodinámica. Es muy común que el soluto cristalice espontáneamente antes de alcanzar la temperatura deseada (metaestable), frustrando el experimento.
¿Por qué es tan difícil con el Nitrato de Potasio (KNO3)?
Este desafío es científicamente esperable y se debe a la naturaleza termodinámica del
KNO3.
Si observas la curva verde en la Figura 2 (más abajo), verás que es la más
empinada de todas.
Esto indica una dependencia extrema de la temperatura: por cada grado que baja la
temperatura, la solubilidad disminuye abruptamente.
A diferencia de sales como el NaCl (cuya curva es casi plana), el KNO3 obliga
al agua a "expulsar" una cantidad masiva de soluto
en muy poco tiempo durante el enfriamiento. Esto crea un estado de alta inestabilidad
energética.
En este punto crítico, el sistema busca desesperadamente volver al equilibrio (estado
sólido). Por ello, se vuelve hipersensible a los núcleos de cristalización:
una simple mota de polvo invisible, una micro-ralladura en las paredes del vaso de
precipitados, o incluso la vibración de la mesa, actúan como "detonantes"
que provocan que todo el exceso de sal precipite de golpe, arruinando el intento de
mantenerla disuelta.
Procedimiento de Laboratorio: Solución Sobresaturada de KNO3
Para preparar con éxito una solución sobresaturada de Nitrato de Potasio sin que cristalice prematuramente, sigue este protocolo estricto:
- 1. Selección de Materiales
- Usa un vaso de precipitados (beaker) de vidrio Pyrex perfectamente limpio y libre de rayones. Cualquier suciedad o imperfección en el vidrio actuará como núcleo de cristalización.
- 2. Agua Destilada
- Utiliza exclusivamente agua destilada de alta pureza. El agua del grifo contiene minerales que provocarán la cristalización inmediata.
- 3. Saturación a Alta Temperatura
- Calienta 100 mL de agua hasta casi ebullición (aprox. 80-90°C). Agrega KNO3 poco a poco bajo agitación constante hasta que ya no se disuelva más (verás unos pocos cristales en el fondo). A esta temperatura, habrás disuelto cerca de 200g de sal.
- 4. Filtración en Caliente (Crucial)
- Filtra rápidamente la solución mientras está caliente para eliminar cualquier cristal no disuelto o impureza sólida. Recibe el filtrado en otro recipiente limpio y precalentado.
- 5. Enfriamiento Lento y Estático
- Cubre el recipiente con Parafilm o un vidrio de reloj limpio para evitar que entre polvo. Deja enfriar la solución a temperatura ambiente sin moverla ni agitarla. El sistema entrará en estado metaestable (sobresaturado).
El Truco de Magia
Una vez fría, la solución parecerá agua pura. Para demostrar que está sobresaturada, deja caer un solo cristalito de KNO3 dentro. ¡Observarás cómo crecen cristales instantáneamente alrededor de él, liberando calor!
La Figura 3 (abajo) muestra visualmente este proceso: cómo la cristalización devuelve la solución a su estado saturado estable.
Por otro lado, analicemos juntos la Figura 2. Es un mapa de cómo la temperatura cambia las reglas del juego. Sigue la línea del Nitrato de potasio (KNO3). ¿Ves cómo se dispara hacia arriba? Esto ocurre porque la mayoría de los sólidos necesitan absorber energía (calor) para romper sus estructuras cristalinas y mezclarse con el agua; es un proceso endotérmico. Al calentar el agua, les "regalamos" esa energía extra, facilitando enormemente su disolución.
Pero busca el Sulfato de cerio (Ce2(SO4)3). ¡Va hacia abajo! Es un "rebelde" químico cuyo proceso de disolución libera calor (es exotérmico). Al igual que nos cuesta más trabajar cuando hace mucho calor, a estos compuestos les cuesta más disolverse a altas temperaturas porque el calor extra del ambiente entorpece su proceso natural de liberar energía. ¡Interactuar con el gráfico te permite visualizar estos principios de la termodinámica!
Figura 2. Solubilidad de varios compuestos iónicos en agua en función de la temperatura.

Figura 3. La cristalización convierte una solución sobresaturada en una solución saturada.
¿Para qué sirven las soluciones sobresaturadas?
Aunque parecen inestables y difíciles de manejar, las soluciones sobresaturadas tienen aplicaciones prácticas muy importantes:
Purificación por Recristalización
Es la técnica número uno para purificar sólidos en química. Al crear una solución sobresaturada caliente y dejarla enfriar lentamente, el compuesto puro cristaliza formando redes ordenadas, mientras que las impurezas (que están en menor cantidad) se quedan disueltas en el "licor madre". ¡Es como un filtro molecular!
Almacenamiento de Calor
¿Has visto esos calentadores de manos (hand warmers) reutilizables? Contienen una solución sobresaturada de acetato de sodio. Al activar un disco metálico, provocas la cristalización inmediata. Como la cristalización libera energía (es exotérmica), la bolsa se calienta instantáneamente a 54°C. ¡Es energía química almacenada lista para usar!
Con los gases ocurre algo curioso, casi opuesto a los sólidos: la mayoría se disuelven peor cuando aumenta la temperatura. Por eso un refresco caliente pierde su gas mucho más rápido que uno frío. ¿Y esto para qué sirve? Piénsalo a escala planetaria: el calentamiento global. Al aumentar la temperatura de ríos y lagos, disminuye la cantidad de oxígeno (un gas) que puede estar disuelto en el agua. Es como si el agua se "asfixiara", poniendo en grave riesgo a los peces y toda la vida acuática.
El Factor Presión: La Ley de Henry
Aquí los gases tienen su propia regla de oro. A diferencia de sólidos y líquidos, la presión afecta enormemente su solubilidad. Piensa en una lata de refresco cerrada. Dentro, el gas (CO2) está a alta presión, forzado a mantenerse disuelto en el líquido.
- Al abrir la lata: La presión baja repentinamente (¡Pssst!). El gas ya no está "obligado" a quedarse disuelto y escapa en forma de burbujas.
- Ley de Henry: Esta ley científica resume el fenómeno: "A mayor presión, mayor solubilidad de un gas". Si duplicas la presión del gas sobre el líquido, duplicas la cantidad de gas que se disuelve.
La Fórmula Matemática
La relación es directamente proporcional y se expresa así:
Sg = kH · Pg
Donde:
- Sg (Solubilidad): Cantidad de gas disuelto (usualmente Molaridad o g/L).
- Pg (Presión): Presión parcial del gas sobre el líquido.
- kH (Constante de Henry): Un valor único para cada gas a una temperatura dada.
*Esto significa que si despejamos la constante, obtenemos una división constante:
kH = Sg / Pg
🎈 Simulador: Ley de Henry
Usa el deslizador para aumentar la presión y observa cómo el gas se disuelve en el líquido.
-- moléculas
Equilibrio
Figura 4. Solubilidades de varios gases en agua en función de la temperatura. Observe que las solubilidades se dan en milimoles por litro (mM) para una presión total constante de 1 atm en la fase gaseosa.
Cálculos Renales y el Fenómeno de Sobresaturación
Los riñones actúan como filtros extremadamente sofisticados, procesando constantemente nuestra sangre para eliminar desechos y exceso de agua a través de la orina. Sin embargo, esta función vital depende de un delicado equilibrio de solubilidad.
Muchos de los desechos que eliminamos, como el calcio, el oxalato y el ácido úrico, son sales poco solubles. Normalmente, permanecen disueltos porque la orina contiene inhibidores naturales que previenen que se junten. Pero cuando este equilibrio se rompe, ocurre la química:
Mecanismo Químico
Cuando bebemos poca agua o consumimos alimentos ricos en ciertas sales, la concentración de estos solutos aumenta. El Oxalato de Calcio ()es el más común, formando cerca del 80% de los cálculos. Se presenta principalmente en dos formas: Monohidrato (más duro y frecuente) y Dihidrato (asociado a hipercalciuria).

Ilustración: Formación de cálculos en el riñón

Estructura: Ion Oxalato coordinando al Calcio
El Proceso de Formación (Litogénesis)
- Sobresaturación: La orina contiene más soluto del que puede mantener disuelto de forma estable.
- Nucleación: Pequeñas partículas (núcleos) comienzan a precipitar (hacerse sólidas).
- Crecimiento de Cristales: Al igual que en la Figura 3, una vez formado el primer cristal, este actúa como "imán" para más moléculas, creciendo hasta formar una piedra visible (cálculo renal).
¿La solución? ¡Diluir la solución!
La prevención más efectiva es química pura: aumentar el volumen del disolvente (agua). Al beber más líquidos, la orina se diluye, bajando la concentración de sales muy por debajo de su punto de saturación (solución insaturada), impidiendo que precipiten.
1. La Física del Buceo Profundo
¿Por qué los buzos no pueden subir rápido a la superficie?
Este es un caso de vida o muerte explicado por la Ley de Henry.
Cuando un buzo desciende, la presión del agua aumenta drásticamente (1 atm extra cada 10
metros).
Respiran aire comprimido a esa misma presión.
- En el fondo (Alta Presión): Según la ley, la solubilidad de los gases aumenta. El nitrógeno del aire se disuelve en grandes cantidades en la sangre y tejidos del buzo.
- Ascenso rápido (Baja Presión): Si el buzo sube de golpe, la presión disminuye bruscamente. La solubilidad del nitrógeno cae instantáneamente.
El Fenómeno Físico: Cavitación/Nucleación
Al igual que al abrir una lata de refresco agitada, el gas "sobra" y ya no puede estar disuelto. Se forman burbujas de nitrógeno dentro de los vasos sanguíneos. Estas burbujas bloquean el flujo de sangre (embolia), causando dolor articular extremo, parálisis o la muerte. Esto se llama Enfermedad por Descompresión.

A mayor profundidad, más gas se disuelve en sangre.
2. Física Atmosférica: ¿Cómo nacen las nubes?
La sobresaturación no solo ocurre en el laboratorio, ¡crea la lluvia!
El aire contiene vapor de agua disuelto. La cantidad que puede "sostener" depende de la temperatura (igual que el azúcar en agua). El aire caliente admite mucho vapor; el aire frío, muy poco.
El Proceso de Nucleación
Cuando una masa de aire húmedo y caliente sube, se enfría. De repente, tiene más vapor del que puede aguantar a esa nueva temperatura fría. Se vuelve una solución sobresaturada de vapor en aire.
Pero el vapor no se vuelve líquido automágicamente. Necesita una "ayuda" física: los Núcleos de Condensación. Pequeñas partículas de polvo, sal marina o humo actúan como el "cristal semilla". Las moléculas de agua se adhieren a ellas y forman gotitas microscópicas. ¡Así nace una nube!

Siembra de Nubes
Usamos este principio físico para provocar lluvia artificial. Aviones dispersan Yoduro de Plata (AgI) en nubes frías. El AgI tiene una estructura cristalina casi idéntica al hielo, engañando al agua para que cristalice sobre él (Nucleación Heterogénea), forzando la precipitación.