Instrucciones
Usted tiene las siguientes opciones en este simulador para moléculas pequeñas tanto inorgánicas como orgánicas.
- En la parte superior, aparecen los botones 2D y 3D para que pueda observar el modelo en dos o tres dimensiones.
- A continuación se presenta el modelo en dos o tres dimensiones.
- "Search" puede ser utilizado para buscar alguna molécula, escribiendo el nombre en inglés, por ejemplo al escribir, sulphuric acid (ácido sulfúrico).
- Color de fondo, sirve seleccionar el color del fondo del modelo en tres dimensiones.
- Acercar +, acerca el modelo.
- Acercar -, aleja el modelo.
- Girar X, Y, Z, para girar el modelo en tres dimensiones en los ejes x, y, z.
- Alambres, varillas y pelotas y varillas, para cambiar el modelo en tres dimensiones en esas representaciones.
- Energía, aparce en la parte superior la energía de la molécula en kJ/mol o kcal/mol.
- Minmizar por MMFF94, normalmente las estructuras iniciales que se crean en los simuladores poseen energías mucho mayores a las que tendría un objeto real, por esta razón, se utilizan algoritmos para calcular las posiciones y fuerzas originales, con el objetivo de minimizarlas y que sean más realistas.
- Arrastrar Minimizar, usted puede arrastrar un átomo, soltarlo y entonces el sistema hace un cálculo de minimización de energía.
- Simetría, muestra los planos de simetría en la molécula.
- Editar, puede editar la molécula agragando o quitando átomos y enlaces.
- Superficie VDW, la superficie de van der Waals de una molécula es una representación abstracta o modelo de esa molécula, que ilustra dónde, en términos muy generales, podría haber una superficie para la molécula en función de los cortes duros de los radios de van der Waals para átomos individuales, y representa una superficie a través de la cual la molécula podría concebirse interactuando con otras moléculas.
- PEM es el mapa de potencial electrostático.
- Tetraedros, para el caso que exista alguna átomo tetraédrico.
- Dipolos enlaces, para ver el los dipolos de todos los enlaces.
- Dipolo molecular, para ver el momento dipolar resultante de toda la molécula.
- Hibridación sp, sp2 y sp3, para ver la hibridacion del átomo de carbono.
- C quiral (nomenclatura R/S) y E/Z para isomería geométrica en alquenos, los descriptores R/S permiten indicar en un compuesto orgánico la configuración (la disposición espacial de los sustituyentes) de un carbono o centro quiral, estereocentro o centro estereogénico, que es el caso de un átomo de carbono con cuatro sustituyentes diferentes. Se añade R o S entre paréntesis como prefijo delante del nombre de la molécula orgánica. En caso de ser más de uno el centro estereogénico, separados por coma se indica el descriptor R o S de cada uno, precedido del número o localizador que identifica su posición.
- Invertir R/S, para cambiar la quiralidad.
- Nomenclatura E/Z en Alquenos, el sistema tradicional para nombrar los isómeros geométricos de un alqueno, en el que los mismos grupos están dispuestos de manera diferente, es nombrarlos como cis o trans. Sin embargo, es fácil encontrar ejemplos donde el sistema cis-trans no se aplica fácilmente.
- N electrones, O electrones y S electrones, para ver los electrones libres del nitrógeno, oxígeno y azufre.
- C primario, C secundario, C terciario, C cuaternario, identifica la clasificación de los átomos de carbono.
- Dadores y aceptores de puentes de hidrógeno, señala los átomos que pueden dar o aceptar puentes de hidrógeno
- Botón 2D, cuando escoge el botón 2D, la aplicación tiene su propio menú y quedan inhabilitados todos los botones 3D.

Lípidos
Saponificación
La hidrólisis de los triacilgliceroles puede efectuarse por varios procedimientos, los más comunes utilizan álcalis o enzimas llamadas lipasas. La hidrólisis alcalina recibe el nombre de saponificación, debido a que uno de los productos de hidrólisis es un jabón, de ordinario, de sales de sodio o potasio de los ácidos grasos.
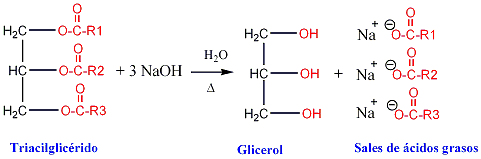
Reacción de saponificación
Halogenación
Los ácidos grasos insaturados, en forma libre o combinada como ésteres en grasas y aceites, reaccionan con los halógenos adicionándose a los dobles enlaces. La reacción de halogenación causa la decoloración de la solución del halógeno. Como el grado de absorción de una grasa o aceite es proporcional al número de dobles enlaces de los ácidos grasos, la cantidad de halógeno que absorbe un lípido puede emplearse como índice del grado de insaturación. El valor del índice se llama índice de yodo y se define como el número de gramos de yodo (o equivalentes de yodo) que se adicionan a una grasa o aceite. Sobre este valor influyen varios factores, entre ellos el porcentaje de ácido insaturado en la molécula de triacilglicerol y el grado de insaturación de cada ácido graso. En general, un valor alto del índice de yodo indica un alto grado de insaturación. Las grasas naturales, las cuales tienen preponderancia de ácidos grasos saturados, poseen índices de yodo entre 10 y 50 aproximadamente; aquellas que contienen ácidos grasos poliinsaturados en abundancia, presentarán índices de yodo entre 120 y 150.

Reacción de halogenación
Hidrogenación
Para transformar aceites vegetales en grasas sólidas se ha desarrollado una industria comercial a gran escala. La química de este proceso de conversión es esencialmente idéntica a la reacción de la hidrógenación catalítica de los alquenos. Al proceso de conversión de aceites a grasas por hidrogenación en ocasiones se le llama endurecimiento. Un método consiste en burbujear hidrógeno gaseoso a presión en un tanque de aceite caliente que contiene un catalizador de níquel finamente dispersado. Un ejemplo es la conversión de la trioleína a triestearina.
