Instrucciones
Usted tiene las siguientes opciones en este simulador para moléculas pequeñas tanto inorgánicas como orgánicas.
- En la parte superior, aparecen los botones 2D y 3D para que pueda observar el modelo en dos o tres dimensiones.
- A continuación se presenta el modelo en dos o tres dimensiones.
- "Search" puede ser utilizado para buscar alguna molécula, escribiendo el nombre en inglés, por ejemplo al escribir, sulphuric acid (ácido sulfúrico).
- Color de fondo, sirve seleccionar el color del fondo del modelo en tres dimensiones.
- Acercar +, acerca el modelo.
- Acercar -, aleja el modelo.
- Girar X, Y, Z, para girar el modelo en tres dimensiones en los ejes x, y, z.
- Alambres, varillas y pelotas y varillas, para cambiar el modelo en tres dimensiones en esas representaciones.
- Energía, aparce en la parte superior la energía de la molécula en kJ/mol o kcal/mol.
- Minmizar por MMFF94, normalmente las estructuras iniciales que se crean en los simuladores poseen energías mucho mayores a las que tendría un objeto real, por esta razón, se utilizan algoritmos para calcular las posiciones y fuerzas originales, con el objetivo de minimizarlas y que sean más realistas.
- Arrastrar Minimizar, usted puede arrastrar un átomo, soltarlo y entonces el sistema hace un cálculo de minimización de energía.
- Simetría, muestra los planos de simetría en la molécula.
- Editar, puede editar la molécula agragando o quitando átomos y enlaces.
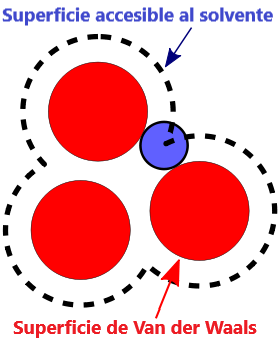
- Superficie VDW, La superficie de van der Waals de una molécula es una representación abstracta o modelo de esa molécula, que ilustra dónde, en términos muy generales, podría haber una superficie para la molécula en función de los cortes duros de los radios de van der Waals para átomos individuales, y representa una superficie a través de la cual la molécula podría concebirse interactuando con otras moléculas.
- PEM es el mapa de potencial electrostático.
- Carga parcial calcula la carga parcial de cada átomo.
- Tetraedros, para el caso que exista alguna átomo tetraédrico.
- Dipolos enlaces, para ver el los dipolos de todos los enlaces.
- Dipolo molecular, para ver el momento dipolar resultante de toda la molécula.
- Hibridación sp, sp2 y sp3, para ver la hibridacion del átomo de carbono.
- Anillo aromático, muestra los anillos aromáticos.
- Heteroátomo, muestra los heteroátomos en heterociclos.
- C quiral (nomenclatura R/S) y E/Z para isomería geométrica en alquenos, los descriptores R/S permiten indicar en un compuesto orgánico la configuración (la disposición espacial de los sustituyentes) de un carbono o centro quiral, estereocentro o centro estereogénico, que es el caso de un átomo de carbono con cuatro sustituyentes diferentes. Se añade R o S entre paréntesis como prefijo delante del nombre de la molécula orgánica. En caso de ser más de uno el centro estereogénico, separados por coma se indica el descriptor R o S de cada uno, precedido del número o localizador que identifica su posición.
- Invertir R/S, para cambiar la quiralidad.
- Nomenclatura E/Z en Alquenos, el sistema tradicional para nombrar los isómeros geométricos de un alqueno, en el que los mismos grupos están dispuestos de manera diferente, es nombrarlos como cis o trans. Sin embargo, es fácil encontrar ejemplos donde el sistema cis-trans no se aplica fácilmente.
- N electrones, O electrones y S electrones, para ver los electrones libres del nitrógeno, oxígeno y azufre.
- C primario, C secundario, C terciario, C cuaternario, identifica la clasificación de los átomos de carbono.
- Dadores y aceptores de puentes de hidrógeno, señala los átomos que pueden dar o aceptar puentes de hidrógeno
- Botón 2D, cuando escoge el botón 2D, la aplicación tiene su propio menú y quedan inhabilitados todos los botones 3D.
Introducción a la Química Orgánica

Escuchar Podcast
Haz clic en el botón para cargar y reproducir el audio.
Definición
La química orgánica es la ciencia que estudia los compuestos que contienen carbono. Estos compuestos además del carbono presentan otros elementos como el hidrógeno, el oxígeno, nitrógeno, fósforo y los halógenos. Al 6 de mayo de 2024, el Registro del Chemical Abstracts Service (CAS) contiene más de 219 millones de sustancias orgánicas e inorgánicas únicas, la mayoría orgánicas. El Registro CAS es una base de datos de sustancias químicas que incluye información como nombres químicos, estructuras y números de registro CAS. También contiene 75 millones de secuencias de proteínas y ADN. El Registro CAS se actualiza diariamente con alrededor de 15.000 nuevas sustancias. Si bien puede parecer extraño que toda una disciplina se dedique al estudio de un solo elemento en la tabla periódica, esto se debe a que hay muchos más compuestos orgánicos que inorgánicos. Estos comuestos químicos afectan virtualmente cada faceta de nuestras vidas, y por esta razón, es importante y útil saber algo sobre ellos. Cada uno tiene propiedades físicas propias, como punto de fusión y punto de ebullición, así como una reactividad química peculiar.
A lo largo de muchos años de experiencia se ha visto que los compuestos orgánicos se pueden clasificar en familias, de acuerdo con sus características estructurales, y que los miembros de determinada familia suelen tener comportamientos químicos parecidos. En lugar de manejar millones millones de compuestos con reactividad aleatoria, hay algunas docenas de familias cuya química se puede predecir razonablemente.
Los compuestos orgánicos constituyen la mayor cantidad de sustancias que se encuentran sobre la tierra. Contienen desde un átomo de carbono como el gas CH4 que utilizamos como combustible, hasta moléculas muy grandes o macromoléculas con cientos de miles de átomos de carbono como el almidón constituído por dos macromoléculas, y (se muestra sólo un fragmento de cada una), las proteínas como la albúmina y los ácidos nucleicos como el ácido desoxirribonucleico
La ropa, los alimentos, las medicinas, la gasolina, los refrigerantes y los jabones están compuestos casi exclusivamente por compuestos orgánicos. Alguno, como el algodón, la lana o la seda, son naturales; es decir, pueden aislarse directamente de fuentes naturales. Otros, como el nylon y el poliéster, son sintéticos, lo que significa que son producidos por químicos en el laboratorio. Al estudiar el principios y conceptos de la química orgánica, se puede aprender más sobre compuestos como estos y cómo afectan el mundo que nos rodea.
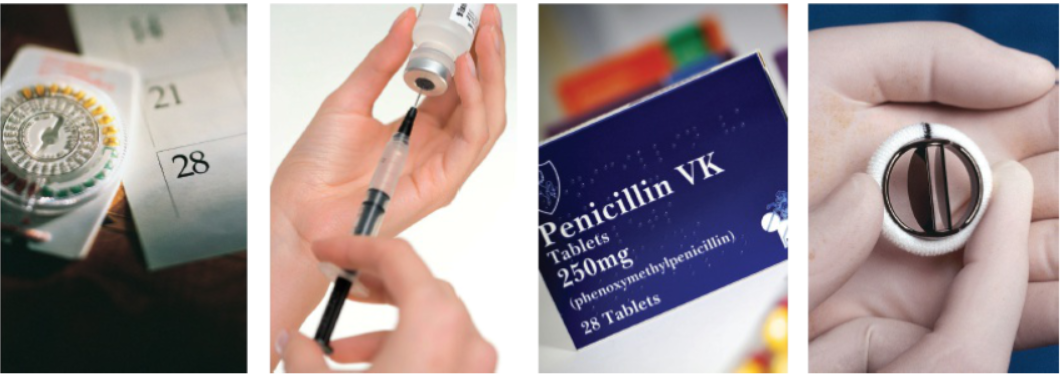
La química orgánica nos ha dado a) Contraceptivos orales, b) Jeringas plasticas, c) Antibióticos, d) Válvulas sintéticas para el corazón.
La existencia de tantos compuestos orgánicos de diferentes tamaños se debe principalmente a:
- La capacidad del átomo de carbono para formar enlaces con otros átomos de carbono.
- La facilidad con que el átomo de carbono puede formar cadenas lineales, ramificadas, cíclicas, con enlaces sencillos, dobles o triples.
Diferencias entre Compuestos Orgánicos e Inorgánicos
Selecciona una característica para ver la comparación detallada.
Cargando características...
¡Atención!
El hombre siempre ha utilizado los compuestos orgánicos y sus reacciones, desde el momento en que descubrió el fuego, cocinó sus alimentos, preparó sus primeras pociones medicinales extrayendo de las plantas compuestos que curaban sus enfermedades.
La química orgánica es un campo inmensamente importante para la tecnología: es la química de los colorantes y las drogas, del papel y las tintas, de las pinturas y los plásticos, de la gasolina y los neumáticos; es la química de nuestros alimentos y de nuestro vestuario.
La química orgánica es fundamental para la biología y la medicina. Los organismos vivos están constituidos principalmente por sustancias orgánicas, además de agua; las moléculas de la biología molecular son orgánicas. A nivel molecular, la biología es química orgánica.
Guía de Estudio
Introducción a la Química Orgánica
Quiz de Comprensión (10 Preguntas de Respuesta Corta)
Instrucciones: Haga clic en el texto de la pregunta para revelar/ocultar su respuesta correcta. Use el botón de abajo para mostrar u ocultar todas las respuestas a la vez.
Preguntas para Ensayo
Instrucciones: Prepare respuestas bien estructuradas a las siguientes preguntas, basándose en su comprensión del texto y sus propias ideas sobre el tema.
-
Compare y contraste las principales propiedades de los compuestos orgánicos e inorgánicos según la tabla proporcionada en el texto.
Piense en aspectos como el tipo de enlace, puntos de fusión y ebullición, solubilidad y velocidad de reacción.
-
Explique por qué la capacidad del átomo de carbono para formar enlaces diversos y estructuras complejas es fundamental para la existencia de la vasta cantidad de compuestos orgánicos.
Concéntrese en la tetravalencia del carbono y su habilidad para formar cadenas (catenación) y enlaces múltiples.
-
Discuta la importancia de la clasificación de los compuestos orgánicos en familias para el estudio y la predicción de su comportamiento químico.
Relacione los grupos funcionales con las propiedades y reactividad similares que definen a cada familia.
-
Analice el papel de la química orgánica en la vida cotidiana, mencionando ejemplos de su presencia en productos naturales y sintéticos.
Incluya ejemplos de alimentos, medicamentos, plásticos, combustibles y productos de higiene que utiliza diariamente.
-
Reflexione sobre la afirmación "A nivel molecular, la biología es química orgánica" y su significado en el contexto de las biomoléculas.
Considere la estructura y función de carbohidratos, lípidos, proteínas y ácidos nucleicos como base de los procesos vitales.
Glosario de Términos Clave
Instrucciones: Haga clic en cada término para mostrar u ocultar su definición.