Teoría de repulsión de pares de electrones de la capa de valencia
GuateQuímica
Lic. Raúl Hernández Mazariegos
Geometría de dominios electrónicos, geometrías moleculares, e hibridaciones de orbitales para un átomo central que contiene dos, tres, cuatro, cinco, o seis dominios electrónicos.
"A" representa el átomo central, "X" representa el dominio (observe que puede haber uno, dos, o tres pares de electrones entre A y X), y "E" representa un dominio electrónico de no-enlace (un par de electrones).
| 2 |
2 |
0 |
lineal |
lineal |
AX2

|
sp |
BeH2,CO2, C2H2


|
180 |


|
| 2 |
1 |
1 |
lineal |
lineal |
AXE

|
sp |
CO, N2


|
N/A |
 |
| 3 |
3 |
0 |
trigonal plana |
trigonal plana |
AX3

|
sp2 |
BH3

|
120 |
 |
| 3 |
2 |
1 |
trigonal plana |
angular |
AX2E

|
sp2 |
SO2

|
119 |
 |
| 4 |
4 |
0 |
tetraédrica |
tetraédrica |
AX4

|
sp3 |
CH4

|
109.5 |
 |
| 4 |
3 |
1 |
tetraédrica |
piramidal trigonal |
AX3E

|
sp3 |
NH3

|
107 |
 |
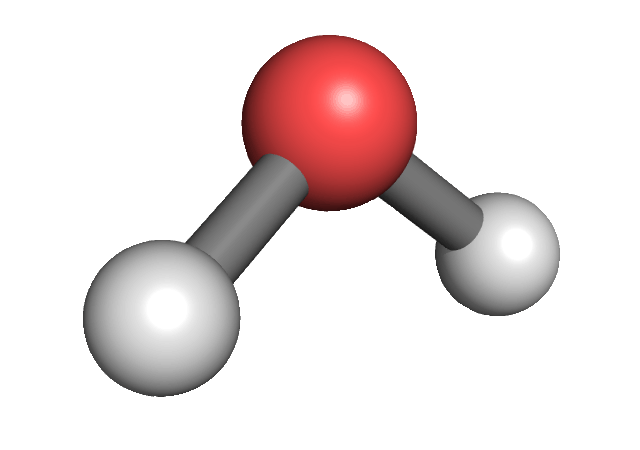
| 4 |
2 |
2 |
tetraédrica |
angular |
AX2E2

|
sp3 |
H2O

|
104 |
 |
| 5 |
5 |
0 |
bipiramidal trigonal |
bipiramidal trigonal |
AX5

|
sp3d |
PF5

|
120 and 90 |
 |
| 5 |
4 |
1 |
bipiramidal trigonal |
balancín |
AX4E

|
sp3d |
SF4

|
|
 |
| 5 |
3 |
2 |
bipiramidal trigonal |
forma de T |
AX3E2

|
sp3d |
ClF3

|
|
 |
| 5 |
2 |
3 |
bipiramidal trigonal |
lineal |
AX2E3

|
sp3d |
XeF2

|
|
 |
| 6 |
6 |
0 |
octaédrica |
octaédrica |
AX6

|
sp3d2 |
SF6

|
180 and 90 |
 |
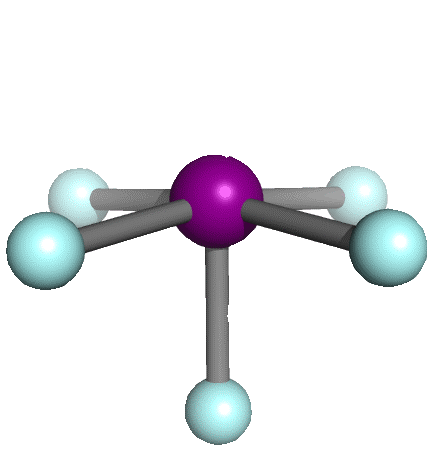
| 6 |
5 |
1 |
octaédrica |
piramidal cuadrada |
AX5E

|
sp3d2 |
IF5

|
|
 |
| 6 |
4 |
2 |
octaédrica |
plana cuadrada |
AX4E2

|
sp3d2 |
XeF4

|
90 |
 |
Ir Arriba












































